Przejdź do artykułu: Kosmetyki dla kosmetyczek, leki dla lekarzy – potrzebujemy definicji medycyny estetycznej?
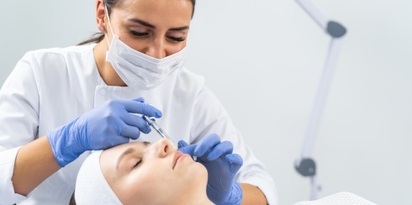
Dokument wydany przez Ministerstwo Zdrowia to kolejny punkt dla lekarzy w sporze o to, czy kosmetolodzy mogą wykonywać zabiegi z zakresu medycyny estetycznej. Jego krytycy wskazują, że komunikat nie jest źródłem prawa. Eksperci zaznaczają jednak, że to tylko wyjaśnienie obowiązujących przepisów, a nie tworzenie nowych, choć nowelizacja również by się przydała. Lekarze podkreślają z kolei, że wstrzyknięcie botoksu czy innego preparatu musi być zarezerwowane dla medyków - błędy to bowiem zazwyczaj konsekwencje na całe życie.